Para llevar a cabo cualquier procedimiento anestésico se emplean fármacos que deprimen el sistema nervioso, cardiovascular y respiratorio. La monitorización e interpretación de los cambios fisiológicos del paciente anestesiado es de vital importancia ya que permite la detección y la anticipación de posibles complicaciones y su posible tratamiento, reduciendo la morbimortalidad en el periodo perianestésico.
Entre las causas más frecuentes de morbimortalidad en pacientes anestesiados destacan la hipotensión, la hipoventilación, la hipoxemia, la hipotermia y algunas arritmias cardiacas. El periodo posoperatorio se considera uno de los más críticos junto con el intraoperatorio, por lo que el paciente debe estar vigilado en todo momento (figura 1).
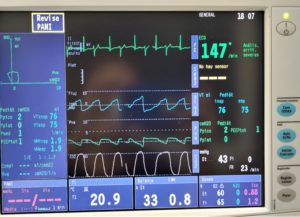
La mayoría de los monitores electrónicos multiparamétricos proporcionan información sobre la función cardiovascular como el electrocardiograma (ECG) y la presión arterial no invasiva (PANI), sobre parámetros relacionados con la ventilación como el porcentaje de hemoglobina saturada con oxígeno (SpO2) y la concentración de dióxido de carbono espirado durante un ciclo respiratorio (EtCO2) y la temperatura corporal. Pero cada vez es más frecuente el empleo de monitorización avanzada en los centros veterinarios, incluyendo parámetros como la presión arterial invasiva (PAI), la espirometría y las fracciones inspirada y espirada de gas anestésico.
Existen otros monitores aún en estudio como el Parasympathetic Tone Activity (PTA), que permite evaluar el grado de nocicepción mediante la diferencia de tono simpático o parasimpático en cada momento o el Bispectral Index (BIS), que se emplea para evaluar la profundidad anestésica. El papel del auxiliar consiste en el uso adecuado y conocimiento del funcionamiento de los equipos de monitorización en su centro de trabajo para prevenir complicaciones durante la anestesia del paciente.
Electrocardiograma
El ECG es un registro gráfico continuo y no invasivo de la actividad eléctrica del corazón a lo largo del ciclo cardiaco: despolarización (contracción) y repolarización (relajación) de las aurículas y los ventrículos. Los impulsos eléctricos se generan en el nódulo sinusal y se transmiten a través de células especializadas hacia el nódulo auriculoventricular, haz de His, ramas fasciculares derecha e izquierda y red de Purkinje.
Las ondas del ECG aparecen positivas o negativas según la colocación de los electrodos y la actividad eléctrica del corazón. La onda P corresponde a la despolarización que provoca la contracción auricular y en condiciones normales es positiva. El complejo QRS representa la despolarización que provoca la contracción ventricular.
- Onda Q: primera onda negativa.
- Onda R: primera onda positiva.
- Onda S: onda negativa que sigue a la onda R.
- Onda T: indica la repolarización ventricular, lo que provoca su relajación y puede ser positiva, negativa o bifásica.
Los electrodos se suelen colocar mediante pinzas conductoras cerca de las axilas en las extremidades anteriores y cerca de los flancos en las extremidades posteriores, o mediante electrodos adhesivos que se pegan a las almohadillas o a la piel previamente rasurada del paciente. Tanto las pinzas como los adhesivos se tienen que colocar directamente en contacto con la piel y lo ideal es impregnarlas con un agente conductor como alcohol o gel para garantizar un buen contacto.
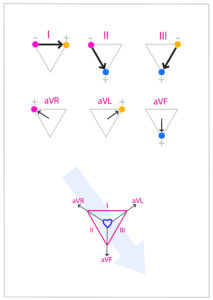
Para identificar su posición cada electrodo presenta un color y suelen estar escritas dos siglas que indican su correcta localización: RA right arm (extremidad anterior derecha) electrodo rojo, LA left arm (extremidad anterior izquierda) electrodo amarillo, RL right leg (extremidad posterior derecha) electrodo negro y LL left leg (extremidad posterior izquierda) electrodo verde. Algunos monitores disponen de un quinto electrodo neutro de color blanco que sirve como tierra. Las derivaciones aVR, aVL y aVF son monopolares y el monitor mide la diferencia de potencial desde un electrodo al centro del triángulo de Einthoven (cerca del centro del corazón).
Las derivaciones I, II y III son bipolares, esto quiere decir que presentan dos polos, uno positivo y uno negativo, y el monitor mide la diferencia de potencial entre los dos electrodos. La derivación II es las más utilizada en anestesia porque muestra las ondas con mayor amplitud y se detectan arritmias más fácilmente (figura 2).
- Derivación I: dirección de RA (-) a LA (+).
- Derivación II: dirección de RA (-) a LL (+).
- Derivación III: de LA (-) a LL (+).
Mediante el uso del ECG se pueden detectar alteraciones en la frecuencia cardiaca como bradicardia o taquicardia y alteraciones en el ritmo (arritmias) como bloqueos auriculoventriculares, ritmos de escape o extrasístoles (figura 3).
Capnografía
La capnografía es la representación gráfica de la presión parcial de dióxido de carbono (CO2) al final de la espiración (EtCO2) durante un ciclo respiratorio. Normalmente, la medición del CO2 se realiza mediante espectrografía infrarroja.
Su uso es de gran utilidad ya que proporciona información sobre la acumulación de CO2, monitoriza la ventilación del paciente de forma continua y no invasiva y, además, alerta de posibles fallos en el equipo como reinhalación por agotamiento de la cal sodada o flujo insuficiente de gas fresco.
Los valores normales de EtCO2 se encuentran entre 35 y 45 mmHg en el perro y 30 y 40 mmHg en el gato.
La mayoría de los capnógrafos son del tipo sidestream, en los que una pequeña fracción del volumen espirado llega al monitor a través de una línea de muestreo. Este sistema tiene un pequeño retardo (algunos segundos) respecto del momento en que se toma la muestra. Cuanto mayor es la longitud de la línea de muestra, mayor retraso en la lectura. Los capnógrafos mainstream tienen el sensor entre el tubo endotraqueal y el circuito anestésico y permite obtener valores a tiempo real. Sin embargo, no son tan frecuentes en veterinaria porque aumentan el espacio muerto del circuito y son potencialmente más frágiles.
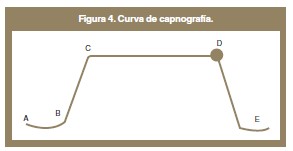
La curva normal de capnógrafo presenta varias fases (figura 4):
- Fase I (A-B): representa la exhalación de gases del espacio muerto.
- Fase II (B-C): resulta de la mezcla de gas del espacio muerto y alveolar.
- Fase III (C-D): corresponde al gas proveniente de los alveolos. El valor observado en el monitor (EtCO2) corresponde con el punto más elevado de esta fase (D).
- Fase 0 (D-E): representa el inicio de la inspiración.
La capnografía es útil para monitorizar:
- El metabolismo, mediante la producción de CO2.
- La colocación del tubo endotraqueal y el circuito respiratorio.
- La perfusión pulmonar (indirectamente, proporciona información sobre el gasto cardiaco).
- La efectividad de la reanimación cardiopulmonar.
La interpretación de la morfología de la curva aporta mucha información sobre la ventilación del paciente (figura 5).
- Animales gestantes u obesos (figura 5A).
- Parada cardiorrespiratoria, embolia pulmonar o disminución del gasto cardiaco (figura 5B).
- Fuga en el sistema respiratorio o en la máquina anestésica (figura 5C).
- Reinhalación (figura 5D).
- El paciente lucha contra el ventilador o por la manipulación del abdomen/tórax por el cirujano (figura 5E).
- “Aleta de tiburón”: obstrucción de la vía aérea, por ejemplo, por acodamiento del tubo endotraqueal, moco en su interior, broncospasmo, asma, etc. (figura 5F).
- Oscilaciones cardiogénicas, por el cambio en el volumen torácico que provocan los latidos, sobre todo con frecuencias respiratorias bajas (fisiológico) (figura 5G).
Bibliografía
- Baker SJ, Pulse oximetry. En: Ehrenwert J, Eisenkraft J, Berry J (editores). Anesthesia equipment principles and applications. USA: Elsevier Saunders. 2013; p. 256-272.
- Bednarski R, Grimm K, Harvey R. AAHA Anesthesia Guidelines for Dogs and Cats. J Am Anim Hosp Assoc. 2011; 47(6):377-385.
- Brodbelt DC, Pfeiffer DU, Young LE, et al. Risk factors for anaesthetic related death in cats, results from the confidential enquiry into perioperative small animal fatalities (CEPSAF). Br J Anaesth. 2007; 99(5):617–23.
- Clark-Price S. Inadvertent Perianesthetic Hypothermia in Small Animal Patients. Vet Clin Small Anim. 2015; 45(5):983-94.
- Duke-Novakovski T, Carr A. Perioperative Blood Pressure Control and Management. Vet Clin Small Anim. 2015; 45(5):965-81.
- Egger C. Anaesthetic complications, accidents and emergencies. En: Duke-Novakovski T, de Vries M, Seymor C. BSAVA Manual of Canine and Feline Anaesthesia and Analgesia. Gloucester: British Small Animal Veterinary Assotiation. 2016; p. 428-444.
- Gil L, Redondo JI. Canine anaesthetic death in Spain: a multicentre prospective cohort study of 2012 cases. Vet Anaesth Analg; 2013:40(6):e57-67.
- Grubb T, Sager J, Gaynor JS, Montgomery E, Parker JA, Shafford H, Tearney C. AAHA Anesthesia and Monitoring Guidelines for Dogs and Cats. J Am Anim Hosp Assoc. 2020; 56(2); p. 59-82.
- Haskins SC. Monitoring anesthetized patients. En: Lumb and Jones. Veterinary anesthesia and analgesia. USA: Willey Blackwell. 2015; p. 100-108.
- Martínez Fernández MA, Martínez Taboada F. Monitorización del sistema respiratorio. En: Sández Cordero I. Manual clínico de Monitorización Anestésica en pequeños animales. España: Servet. 2019; p. 61-72.
- Martínez Pino J. Monitorización ventilatoria. En: Martínez Pino J. Manual de Ventilación Mecánica en pequeños animales. España: Multimédica Ediciones Veterinarias. 2018; p. 50-53.
- Matthews NS, Mohn TJ, Yang M, et al. Factors associated with anesthetic-related death in dogs and cats in primary care veterinary hospitals. J Am Vet Med Assoc. 2017; 250(6):655–66.
- Mosing M. General principles of perioperative care. En: Duke-Novakovski T, de Vries M, Seymor C. BSAVA Manual of Canine and Feline Anaesthesia and Analgesia. Gloucester: British Small Animal Veterinary Assotiation. 2016; p. 16-23.
- Rodriguez-Diaz J, Hayes G, Boesch J. Decreased incidence of perioperative inadvertent hypothermia and faster anesthesia recovery with increased environmental temperature: A nonrandomized controlled study. Vet Surg. 2019; 49(2): p. 1-9.
- Sandez Cordero I. Manual clínico de monitorización anesésica en pequeños animales. España: Servet. 2019; p. 1-16.
- Schauvliege S. Patient monitoring and monitoring equipment. En: Duke-Novakovski T, de Vries M, Seymor C. BSAVA Manual of Canine and Feline Anaesthesia and Analgesia. Gloucester: British Small Animal Veterinary Assotiation. 2016; p. 77-96.